دوره 8، شماره 1 - ( بهار 1401 )
جلد 8 شماره 1 صفحات 73-62 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Meraji M, Fazaeli S, ٍEbnehoseini Z, Bameri H. Reporting Adverse Drug Reactions With Emphasis on the Designing National Minimum Data Set. JMIS 2022; 8 (1) :62-73
URL: http://jmis.hums.ac.ir/article-1-333-fa.html
URL: http://jmis.hums.ac.ir/article-1-333-fa.html
معراجی مرضیه، فضایلی سمیه، ابن حسینی زهرا، بامری هانیه. گزارشدهی عوارض ناخواسته دارویی با تأکید بر طراحی مجموعه حداقل دادههای ملی. اطلاعرسانی پزشکی نوین. 1401; 8 (1) :62-73
گروه فناوری اطلاعات سلامت، دانشکده علوم پیراپزشکی، دانشگاه علومپزشکی مشهد، مشهد، ایران.
متن کامل [PDF 4602 kb]
(1751 دریافت)
| چکیده (HTML) (2955 مشاهده)
متن کامل: (7240 مشاهده)
مقدمه
هدف طب، حفظ و ارتقای سطح سلامت جامعه و اعاده آن در بیماران است. این هدف از طریق مجموعهای از عوامل تحقق مییابد که تهیه توزیع و مصرف صحیح دارو یکی از عوامل اصلی آن است. درواقع مصرف دارو از ارکان مهم درمان بیماری است و 75 درصد از درمان بیماران با تجویز دارو صورت میگیرد.اما مصرف غیرمنطقی آن علاوه بر عدم درمان بیماری موجب ایجاد عوارض دارویی در طولانیمدت نیز میشود [1]. در ایالات متحده مرگومیر ناشی از عوارض جانبی داروها یکی از شایعترین دلایل مرگومیر است. بهطوریکه در سالهای اخیر عوارض و مشکلات دارویی چهارمین الی ششمین عامل مرگومیر در ایالات متحده آمریکا تخمین زده شده است. مرگومیر ناشی از عوارض دارویی در طول یک سال بیش از مرگومیر سالانه ناشی از تصادفات با وسایل نقلیه، سرطان پستان و ایدز گزارش شده است [2]. مطالعات تخمین میزنند که 6/7 درصد از بیماران بستری در بیمارستان با واکنش دارویی جدی روبهرو هستند که میزان کشندگی آن 0/32 درصد است. اگر این تخمینها درست باشد، در بیماران بستری بیش از 2216000 عوارض ناخواسته دارویی جدی وجود دارد که سالانه باعث بیش از 106000 مرگ میشود [3]. عارضه جانبی دارویی براساس تعریف سازمان بهداشت جهانی، به هرپاسخی از دارو اطلاق میشود که مضر و یا ناخواسته بوده و با مقادیری که بهصورت معمول جهت پیشگیری، تشخیص و درمان و یا بهمنظور اصلاح عملکرد فیزیولوژیکی استفاده میشود، اتفاق میافتد [4].
وقایع ناخواسته دارویی همواره بهعنوان یک مسئله بهداشت عمومی، ابعاد مختلفی داشته و میتواند اثرات جبرانناپذیر و هزینههای فراوانی را برای افراد جامعه به همراه داشته باشد [5].پس از وقوع فاجعه تالیدوماید در دهه 1960 میلادی ضرورت توجه و شناسایی هرچه سریعتر عوارض جانبی داروهای واردشده به بازار احساس شد. بر همین اساس سازمان بهداشت جهانی در سال 1968 فارماکوویژیلانسی را بهمنظور نظارت بر بیخطری داروها پیریزی کرد. بنا به تعریف سازمان بهداشت جهانی به دانش و فعالیتهای مرتبط با ردیابی، ارزیابی، گزارشدهی و پیشگیری از عوارض دارویی یا سایر مشکلات مرتبط با دارو فارماکوویژیلانس گفته میشود. هدف عمده سیستمهای فارماکوویژیلانس شناسایی آن دسته از رویدادهای ناگوار مرتبط با مصرف داروهایی است که ناشناخته هستند [6].
در کشورهای مختلف روشهای متفاوتی بهمنظور شناسایی عوارض جانبی دارویی بهصورت داوطلبانه در مراکز گزارشدهی عوارض ناخواسته دارویی وجود دارد [7]. نخستین ایدهها درجهت رایانهای کردن ثبت و بررسی عوارض دارویی در اواسط دهه 1970 میلادی شکل گرفته است [8]. توسعه و راهاندازی این تکنیکهای رایانهای که بهطور عمده برمبنای تسهیل جستوجو و دستیابی به ارتباطات جدید عوارض دارویی است، همچنان رو به افزایش است [9]. همگام با فعالیتهای صورتگرفته در بسیاری از کشورهای جهان درزمینه بررسی عوارض دارویی، در کشور ما نیز مرکز ملی ثبت و بررسی عوارض ناخواسته داروها، عهدهدار سازماندهی فعالیتهای فارماکوویژیلانس و جمعآوری و بررسی گزارشات عوارض دارویی درسطح کشور است [6].
گزارشدهی عوارض ناخواسته دارویی در انگلستان از طریق «کارت زرد» است. این طرح گزارشدهی داوطلبانه در سال 1964 راهاندازی شد و اکنون وزارت نظارت بر داروها و محصولات بهداشتی ادارهاش میکند. سیستم گزارش «کارت زرد» بهعنوان اولین سیستم گزارشدهی در جهان شناخته شده است [10].
مدافکت یکی از استراتژیهای دسترسی به درمان در حال پیشرفت در کاناداست. استراتژی 5 ساله برای بهبود ایمنی، اثربخشی و دسترسی به محصولات درمانی که در اختیار کاناداییهاست با فراهم کردن دسترسی متمرکز به اطلاعات مناسب و قابلاطمینان، به گزارشدهی عوارض جانبی به وزارت بهداشت کانادا و شناسایی خطرات احتمالی با استفاده از این اطلاعات میپردازد [11]. در استرالیا گزارشهای داوطلبانه با استفاده از «کارت آبی» صورت میگیرد که متخصصان بهداشت، شرکتهای داروسازی و مصرف کنندگان ارسالشان میکنند. کمیته مشاوره واکنشهای دارویی که در سال 1970 تأسیس شد، گزارشهای ارسالی را ارزیابی میکند. سیستم «کارت آبی» استرالیا از نظر گزارشهای سرانه یکی از بهترینهای جهان است و نرخ گزارشهای آن بهمرور زمان افزایش یافته است [7].
در ایالات متحده آمریکا گزارشدهی به صورت برخط (به صورت الکترونیکی از سال 1997) یا از طریق تلفن، با ارسال فرم مشخص از طریق پست یا فکس انجام میشود. گزارشات عوارض ناخواسته دارویی در پایگاه داده سیستم گزارشدهی وارد میشوند و دفتر سازمان غذا و دارو آمریکا با ارزیابی خطر پس از بازاریابی، واکنشهای جدی را شناسایی میکند [12].
بهکارگیری عناصر استاندارد همراه با تعاریف یکسان بهعنوان مجموعه حداقل داده، به افزایش مقایسه و تطابق دادهها منجر میشود. در پزشکی جدید، دادههای زیادی تولید میشود، اما همواره بین گردآوری داده تا درک و تفسیر آن فاصلهای وجود دارد و از سوی دیگر دادههای دردسترس، حجیم و گیجکننده هستند. برای همین، مجموعه حداقل دادهها جمعآوری میشود که روش استانداردی برای جمعآوری عناصر دادهای کلیدی است تا فهم آسان و امکان مقایسه آنها فراهم شود و ملاحظات دولتی و نیازهای درونی هر مؤسسه و درنهایت جامعه پزشکی را برآورده کند [13]. در تمام کشورها فرم گزارشدهی داوطلبانه واکنش عوارض ناخواسته دارویی، مهمترین و اصلیترین ابزار سیستم مراقبت دارویی است. این فرم ابزار جمعآوری اطلاعات مرتبط به واکنشهای نامطلوب دارویی است که به شناخت رابطه علی بین داروی مشکوک و واکنش کمک میکند. ثبت اطلاعات ناکافی درباره واکنشهای نامطلوب دارویی موجب ناکارآمدی گزارشها برای مراجع نظارتی میشود، زیرا از اطلاعات هیچ نتیجه را نمیتوان استخراج کرد. اکثر کشورها فرم گزارشدهی داوطلبانه برای ثبت و جمعآوری دادههای مربوط واکنشهای نامطلوب دارویی خود ایجاد کردهاند. همچنین خبرنامه دارویی سازمان جهانی بهداشت نیاز به طراحی فرم عمومی برای گزارش داوطلبانه واکنشهای نامطلوب دارویی را مطرح کرده است [14].
فرایند گزارشدهی عوارض ناخواسته دارویی در ایران از سال 1377 بهصورت رسمی آغاز شده است و از طریق تکمیل و ارسال کارت زرد به مراکز گزارشدهی عوارض ناخواسته دارویی در معاونت غذا و دارو عوارض گزارش میشود. با طراحی وبسایت ملی ثبت گزارش عوارض ناخواسته دارویی از سال 1393 این فرایند تسهیل شده است. گزارشدهی عوارض جانبی داروها به طور مستمر موجب شناسایی، جمعآوری و ارزیابی کارآمد عوارض دارویی میشود. با تعیین عوارض، حمایت از تصمیمگیری در مورد داروها در سطوح مختلف سیستم مراقبتهای بهداشتی نیز تسهیل میشود [15, 16].
این مطالعه با هدف بررسی تفاوتهای سیستم گزارش عوارض ناخواسته دارویی ایران با سایر کشورهای در این حوزه انجام شد. در طی بررسی عناصر اطلاعاتی، شناسایی و نیاز به وجود عناصر دادهای مشترک جهت مقایسه با دادههای بینالمللی مشخص شد. درنهایت این مطالعه با هدف تعیین مجموعه حداقل دادههای موردنیاز گزارشدهی عوارض ناخواسته دارویی انجام شد.
مواد و روشها
این مطالعه از نوع کاربردی بود که به روش توصیفیتطبیقی و با استفاده از تکنیک دلفی در سال 1399 در سه مرحله انجام شد.
در مرحله اول، بررسی متون و انتخاب کشورها شامل، آمریکا، کانادا، انگلستان و استرالیا بهجهت سرآمد بودن درزمینه ثبت عوارض ناخواسته دارویی و داشتن برنامه جامع و الگو صورت گرفت. همچنین کشور هندوستان بهدلیل قرابت جغرافیایی در قاره آسیا با ایران برای بررسی برنامههای نظارت بر عوارض ناخواسته دارویی انتخاب شد. دستورالعملها، فرمها و وبسایتهای طراحیشده در این کشورها جهت ثبت و گزارش عوارض ناخواسته دارویی بررسی گردید. پایگاههای اطلاعاتی معتبر نظیر وبآوساینس، اسکوپوس و پابمد براساس ترکیبات مختلف کلیدواژههای adverse drug reaction reporting systems, drug side effect, drug adverse reactions, adverse drug events, AND “Health Information Systems, Health Information Systems, Health Informatics Systems, medical Informatics Systems , Set Data Minimum از سال 2010 تا 2020 جستوجو شدند.
در مرحله دوم، بر اساس جداول تطبیقی، لیستی از مجموعه حداقل داده با توجه به وجوه اشتراک و افتراق در عناصر اطلاعاتی کشورهای منتخب تنظیم شد. بدینترتیب که اگر عناصر اطلاعاتی در بیش از دو کشور یا بیشتر موجود بود، در مجموعه حداقل داده پیشنهادی قرار گرفت. در مرحله آخر اعتبارسنجی مجموعه حداقل داده پیشنهادی با استفاده از روش دلفی با نظرخواهی از 15 صاحبنظر انجام شد. ملاک انتخاب این افراد تحصیلات مرتبط دکتری داروسازی، مدیریت اطلاعات سلامت و داشتن سابقه فعالیت درزمینه ثبت عوارض ناخواسته دارویی و داشتن تخصص در حوزه مدیریت اطلاعات سلامت بود. بدینترتیب لیست مجموعه حداقل دادههای اولیه پیشنهادی با مقیاس لیکرت 5 گزینهای طراحی و برای هر عنصر داده با توجه به اهمیت ارزش 1 (خیلی کم) تا 5 (خیلی زیاد) در نظر گرفته شد. روایی مجموعه حداقل داده اولیه پیشنهادی، براساس نظرات سه نفر از خبرگان حوزه مدیریت اطلاعات سلامت و دو نفر داروساز که با با سیستمهای گزارشدهی عواض دارویی آشنا بودند، سنجیده شد. سپس مجموعه حداقل داده پیشنهادی به صورت الکترونیک و حضوری در اختیار صاحبنظران قرار داده شد. پس از امتیازدهی صاحبنظران، تمامی عناصر داده با کسب درجه اهمیت بیشتر از 3 در مجموعه حداقل دادههای ثبت عوارض ناخواسته دارویی قرار گرفتند. عناصری که ارزش اهمیت بهدستآمده کمتر از 2 را کسب کردند، از مجموعه حداقل داده پیشنهادی حذف شدند. صاحبنظران مشتمل بر 12 داروساز با تحصیلات دکترای عمومی داروسازی و مسئولین گزارش عوارض ناخواسته دارویی در بیمارستان و 3 متخصص مدیریت اطلاعات سلامت بودند. این افراد بهصورت داوطلبانه به همکاری دعوت شدند. جهت گردآوری دادهها از فرم استخراج داده استفاده شد که شامل اطلاعات مربوط به دارو، بیمار، عارضه، بیمارستان، گزارشگر، نحوه تهیه دارو، سابقه پزشکی و اقدامات و سابقه پزشکی و تست آزمایشگاهی بود . این اطلاعات وارد نرمافزار اکسل نسخه 2019 شد.
یافتهها
درمجموع 109عنصر داده شناسایی شد. بر اساس وجوه اشتراک در کشورهای منتخب، 45 عنصر داده به نظرسنجی گذاشته شد که درباره 33 عنصر داده در مرحله اول دلفی توافق جمعیشد. 6 عنصر (شماره پرونده پزشکی بیمار، تاریخ تولد بیمار، فکس یا ایمیل بیمارستان، آدرس گزارشگر، شهر/کشور گزارشگر و دسترسی به دارو) پس از مصرف حذف شدند. 6 عنصر (آدرس بیمارستان، ثبت علت احتمالی ایجادعارضه، فراوانی ، علت مصرف، تلفن/ایمیل گزارشگر و اقدام انجامشده) درصورت بروز عارضه بین 2 تا 3 نمره کسب کردند و وارد مرحله دوم دلفی شدند. پس از انجام دور دوم دلفی، 39 عنصر داده درمجموع حداقل نهایی مورد اجماع صاحبنظران قرار گرفت (جدول شماره 1).
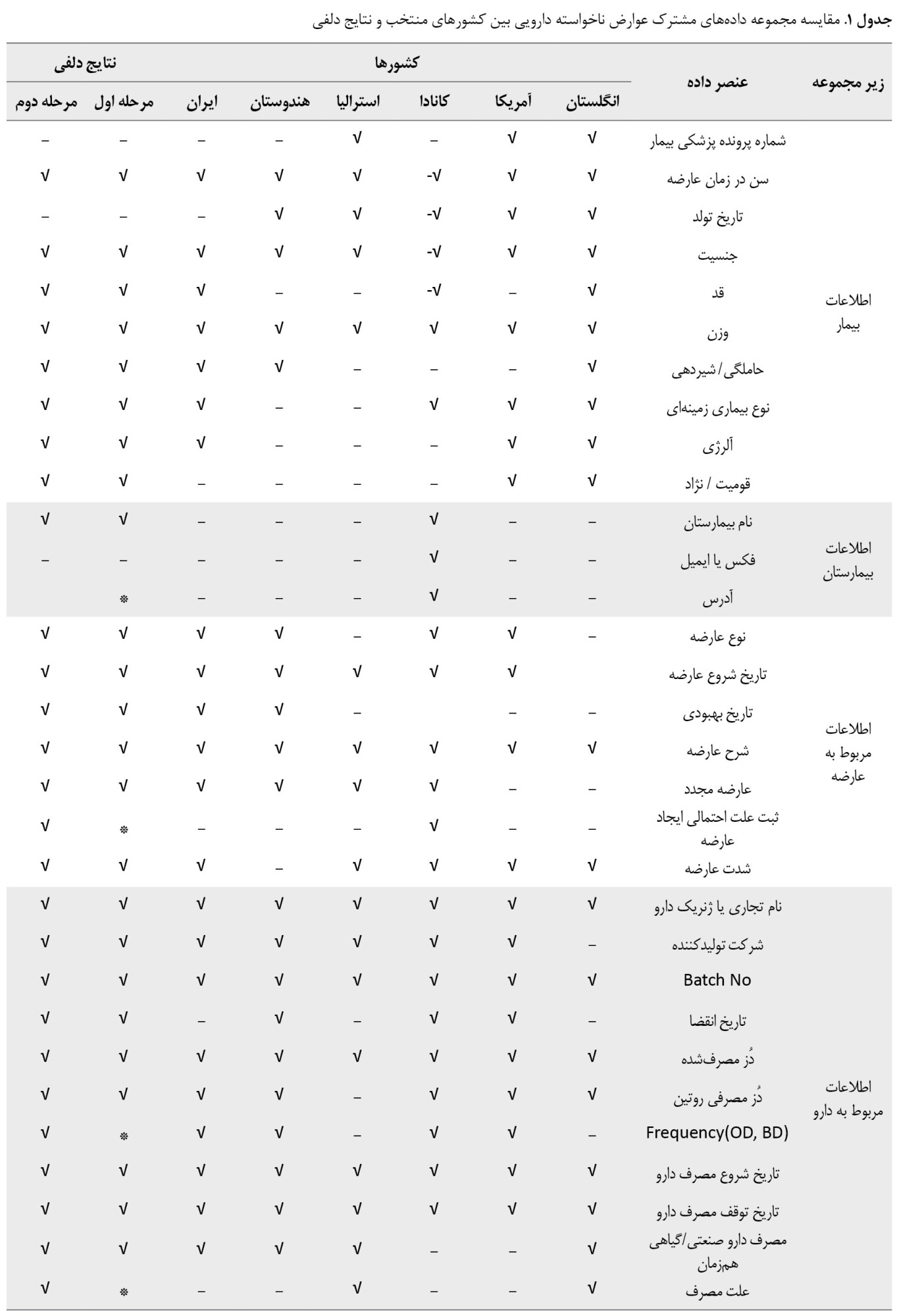
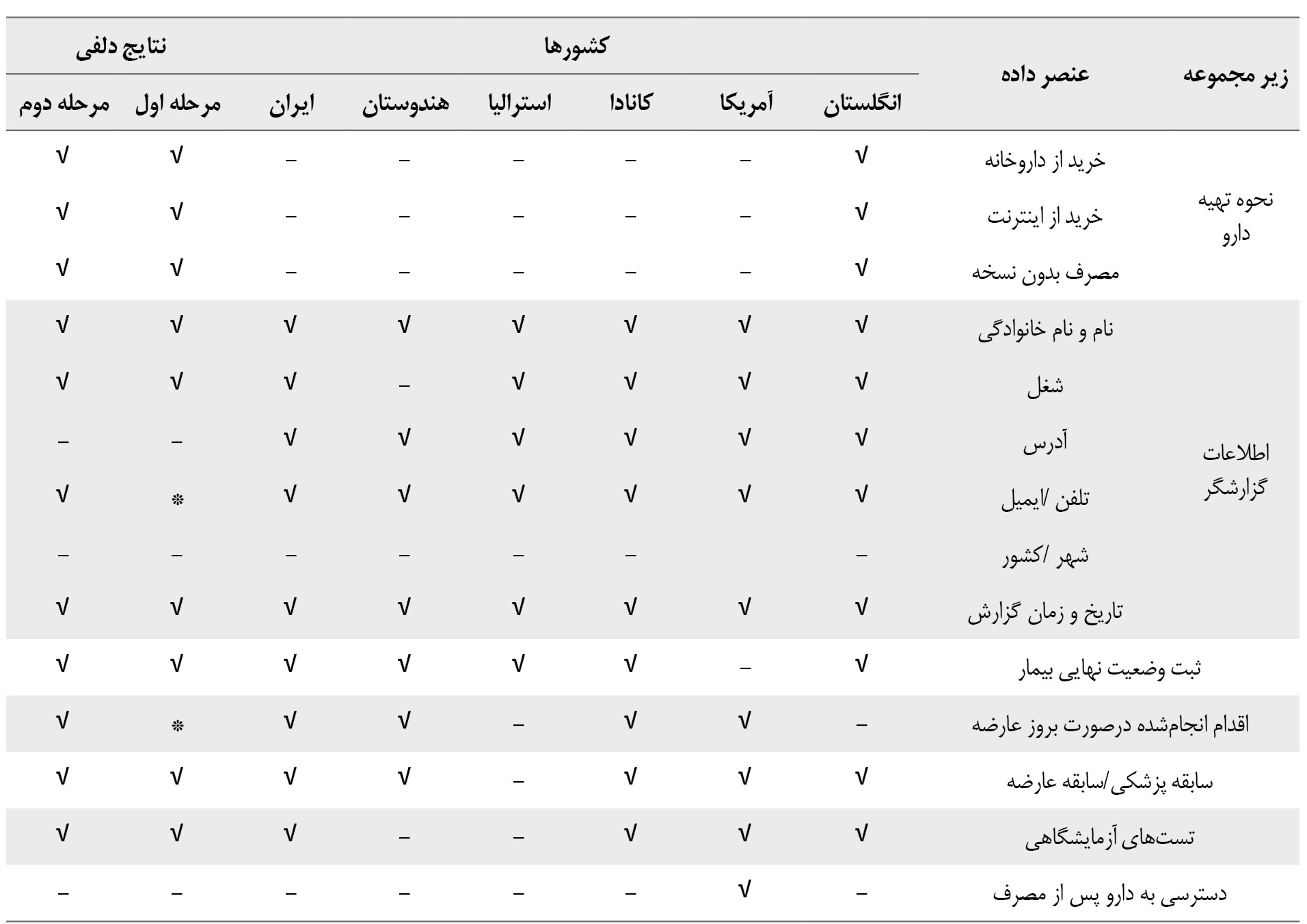
طبق نتایج مطالعه حاضر بعد از بررسی کشورهای منتخب و انجام دلفی، 39 عنصر اطلاعاتی در 7 محور مشخص شد: اطلاعات بیمار (8 عنصر)، بیمارستان (2 عنصر)، عارضه (7 عنصر)، دارو (11 عنصر)، نحوه تهیه دارو (3 عنصر)، گزارشگر (4 عنصر اطلاعاتی) و سایر موارد (4 عنصر اطلاعاتی) (جدول شماره 2).
.jpg)
سیستم گزارش «کارت زرد» انگلستان بهعنوان اولین سیستم گزارشدهی در جهان مواردداروی مشکوک، واکنشهای مشکوک، جزئیات اطلاعات بیمار، اطلاعات گزارشدهنده، اطلاعات تکمیلی و واکنشهای جدی را گزارش میدهد [10].
در کانادا یک وبسایت برای همکاری انجمنهای متخصصین مراقبت سلامت و گروههای مصرفکننده / بیمار طراحی شده است و الزامات اطلاعاتی برای عوارض جانبی شامل نام بیمارستان و اطلاعات تماس نماینده آن بیمارستان، نام تجاری دارو یا نام عمومی آن، شماره شناسایی اختصاص دادهشده برای دارو، سن و جنس بیمار، توصیف واکنش جدی جانبی دارویی، تاریخی که برای اولین بار واکنش جدی دارویی ثبت شده است، تاریخی که بیمار برای اولین بار از دارو استفاده کرده، تاریخی که در آن اولین واکنش جانبی جدی دارویی رخ داده است و درصورت وجود، تاریخی که سلامتی بیمار قبل از واکنش به حالت قبل برگردانده شده است، هر وضعیت پزشکی بیمار که مستقیماً به واکنش جدی و جانبی دارو مربوط میشود، هرگونه محصول درمانی که همزمان بیمار استفاده میکند و تأثیر واکنش جدی جانبی دارویی بر سلامت بیمار را دربر میگیرد [17]
در ایران، وزارت بهداشت سیستم ملی گزارشدهی عوارض ناخواسته دارویی را در سال 1370 تأسیس کرد. درسال 1377 سازمان بهداشت جهانی این سیستم را پذیرفت. کلیه دانشگاههای علومپزشکی و مراکز دولتی و خصوصی، مسئولیت ارسال گزارش را برعهده دارند. حداقل اطلاعات لازم جهت گزارش عارضه ناخواسته دارویی: مشخصات بیمار، مشخصات گزارشگر عارضه رخداده مشکوک به مصرف دارو و نام دارو/داروهای مشکوک به ایجاد عارضه [15 ،9]
بحث
گزارشدهی عوارض ناخواسته دارویی بهعنوان بخش مهمی از نظارت و ایمنی دارو در سطح بینالمللی در نظر گرفته میشود [18]. پراکندگی اطلاعات، حجم زیاد دادهها وعدم دسترسی بهموقع به آنها برای ارائهدهندگان مراقبتهای بهداشتی، مستندسازی ضعیف اطلاعات و وجود اطلاعات تکراری ازجمله مشکلات سیستمهای اطلاعاتی موجود است. بهکارگیری عناصر استاندارد همراه با تعاریف یکسان بهعنوان مجموعه حداقل داده، به افزایش میزان درک و تفسیر دادهها منجر میشود [19]. سازمان بهداشت جهانی اطلاعات مربوط به عوارض جانبی را از تمام کشورهای عضو برنامه بینالمللی نظارت بر دارو دریافت میکند. بنابراین دادههای دریافتشده باید یکنواخت و کامل باشد تا بتوان نتیجهگیریهای معنیدار به دست آورد [14].
تمام کشورها اعم از پیشرفته و در حال توسعه از اهمیت وجود برنامه نظارت برعوارض ناخواسته دارویی آگاهی داشتند و چنین برنامهای را اجرا میکردند. در این میان انگلستان از سال 1964 پیشتاز بوده است. هندوستان و عربستان از سال 1997 و 2003 به برنامه جهانی پیوستند. در ایران در ژوئن سال 1998 سیستم ملی گزارشدهی راهاندازی شد [12]. نحوه ارسال گزارشات در تمام کشورها بهصورت ساده و کاغذی، وبسایت و تلفن/فکس است. در استرالیا ارسال گزارشات بهصورت کاغذی وجود ندارد. از اپلیکیشن فقط درکانادا، انگلستان، آمریکا، هندوستان و ایران استفاده میشود. در مطالعه والینسیوت-یانکائوسکین روی 12 کشور اروپایی نیز روشهای مورداستفاده برای گزارشدهی عوارض ناخواسته دارویی، پست مستقیم، ایمیل، تماس تلفنی، فکس و روشهای آنلاین مبتنی بر اینترنت بود. در استونی و اتریش تماس تلفنی علاوه بر فرم کتبی استفاده میشود. در مطالعه در فنلاند هم فرم گزارش آنلاین وجود نداشت [20]. در مطالعه نوکیک و همکاران در پنج کشور آسیایی فیلیپین، نپال، کامبوج، تایلند و بنگلادش، در همه کشورها بهجز بنگلادش از فناوریهای ارتباطی برای گزارش عوارض دارو ازجمله تلفن، فکس، اینترنت، ایمیل، رایانه و نرمافزار برای گزارش استفاده میشود [21].
در مطالعه مارگراف مشخص شد از 44 کشور موردبررسی درمجموع 31 کشور گزارش آنلاین و کاغذی دارند، 11 کشور فقط از گزارش کاغذی استفاده میکردند و در هند بیماران از طریق تلفن گزارش میدهند، در نیجریه پیامهای متنی ارسال میشود. 68 درصد کشورها سابقه بیماری و 93 درصد کشورها درمان همزمان و 95 درصد کشورها ارزیابی علت برای تجزیهوتحلیل بهتر در فرمها در نظر گرفته بودند [22].
در مطالعه حاضر اطلاعات بیماران شامل سن، جنسیت، قد، وزن، حاملگی / شیردهی، بیماری زمینهای، آلرژی، قومیت و نژاد بود و در مطالعه بایلی برای توصیف وضعیت بیمار عناصر داده شامل اطلاعات جمعیتشناختی و سابقه پزشکی بود و بر گزارش سن و جنس تأکید شده بود [23]. طبق مطالعه باندکار ثبت آلرژی و وضعیت بارداری از پارامترهای مهم برای ارزیابی علت وقوع عوارض ناخواسته دارویی در بیماران زن است و در تمام کشورها بررسی میشود [14].
در مطالعه بایلی و همکاران اکثر سیستمهای موردبررسی نشان داد که طراحی توسط خود کشورها بوده و در وبسایتهای سازمانهای داروسازی استفاده میشدند. در این وبسایتها درجه بالایی از تنوع و عدم استانداردسازی بین سیستمها مشهود بود. اصطلاحات، عبارات و سؤالات متعددی برای متغیرهای مشابه استفاده میشد و تعاریف استانداردی وجود نداشت. برای مثال، اصطلاحات حادثه جانبی، واکنش ناخواسته، حادثه و مشکل مربوط به دارو همه بهجای یکدیگر و بدون تعریف صریح استفاده میشوند. فقدان استاندارد بین سیستمها به احتمال زیاد قابلیت مقایسه دادههای تولیدشده با استفاده از سیستمهای مختلف را محدود میکند و ممکن است تلاشها را برای تجمیع و تجزیهوتحلیل دادهها تضعیف کند [23]. تفاوتها و تنوع دادهها در مجموعه داده کشورهای منتخب، نیازسنجی از ذینفعان و کسب نظر متخصصین برای تعیین مجموعه حداقل داده اهمیت دارد.
نتیجهگیری
بهکارگیری عناصر استاندارد همراه با تعاریف یکسان به عنوان مجموعه حداقل داده، به افزایش میزان درک و تفسیر دادهها منجر میشود. بنابراین دادههای تولیدشده در حوزه عوارض دارو باید یکنواخت و کامل باشند تا بتوان نتیجهگیریهای معنیدار به دست آورد. در تمام کشورها فرم گزارشدهی داوطلبانه واکنش عوارض ناخواسته دارویی، مهمترین و اصلیترین ابزار سیستم مراقبت دارویی است. تفاوتها و تنوع دادهها در مجموعه داده کشورها، نیازسنجی از ذینفعان و کسب نظر متخصصین برای تعیین مجموعه حداقل داده اهمیت دارد. در ایران در ژوئن سال 1998 سیستم ملی گزارشدهی راهاندازی شد. انتظار میرود سامانه ملی با استفاده از مجموعه حداقل دادههای این مطالعه براساس نیازهای کاربران و استانداردها طراحی و مجدداً بازبینی شود.
یکی از محدودیتهای این مجموعه نبود دسترسی آسان به فرمهای گزارشدهی بود. محدودیت دیگر دستهبندی زیرمجموعهها بر اساس فراوانی آنها و پراکنده بودن زیاد در کشورهای موردمطالعه بود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله برگرفته از پایاننامه کارشناسی ارشد مصوب جلسه شورای پژوهشی دانشگاه علومپزشکی مشهد با کد اخلاق IR.MUMS.REC.1398.056 است.
حامی مالی
این مقاله حاصل پایاننامه کارشناسی ارشد هانیه بامری با عنوان «ارزیابی کاربردپذیری و بررسی قابلیتهای عملکردی سامانه ملی ثبت عوارض ناخواسته دارویی» است که دانشگاه علومپزشکی مشهد و با کد طرح 971701 آن را تصویب کرده است. همچنین این مطالعه با حمایت مالی معاونت پژوهشی دانشگاه علومپزشکی مشهد انجام شده است.
مشارکت نویسندگان
بررسی مقالات مطالعه، مقدمه، روش، بحث و نتیجهگیری: مرضیه معراجی و هانیه بامری، انتخاب مطالعه: سمیه فضائلی و زهرا ابن حسینی؛ ویرایش: سمیه فضائلی.
تعارض منافع
بنابر اظهار نویسندگان در این مقاله تعارض منافع وجود ندارد.
تشکر و قدردانی
نویسندگان از دانشگاه علومپزشکی مشهد برای حمایت از این پروژه تشکر می کنند.
هدف طب، حفظ و ارتقای سطح سلامت جامعه و اعاده آن در بیماران است. این هدف از طریق مجموعهای از عوامل تحقق مییابد که تهیه توزیع و مصرف صحیح دارو یکی از عوامل اصلی آن است. درواقع مصرف دارو از ارکان مهم درمان بیماری است و 75 درصد از درمان بیماران با تجویز دارو صورت میگیرد.اما مصرف غیرمنطقی آن علاوه بر عدم درمان بیماری موجب ایجاد عوارض دارویی در طولانیمدت نیز میشود [1]. در ایالات متحده مرگومیر ناشی از عوارض جانبی داروها یکی از شایعترین دلایل مرگومیر است. بهطوریکه در سالهای اخیر عوارض و مشکلات دارویی چهارمین الی ششمین عامل مرگومیر در ایالات متحده آمریکا تخمین زده شده است. مرگومیر ناشی از عوارض دارویی در طول یک سال بیش از مرگومیر سالانه ناشی از تصادفات با وسایل نقلیه، سرطان پستان و ایدز گزارش شده است [2]. مطالعات تخمین میزنند که 6/7 درصد از بیماران بستری در بیمارستان با واکنش دارویی جدی روبهرو هستند که میزان کشندگی آن 0/32 درصد است. اگر این تخمینها درست باشد، در بیماران بستری بیش از 2216000 عوارض ناخواسته دارویی جدی وجود دارد که سالانه باعث بیش از 106000 مرگ میشود [3]. عارضه جانبی دارویی براساس تعریف سازمان بهداشت جهانی، به هرپاسخی از دارو اطلاق میشود که مضر و یا ناخواسته بوده و با مقادیری که بهصورت معمول جهت پیشگیری، تشخیص و درمان و یا بهمنظور اصلاح عملکرد فیزیولوژیکی استفاده میشود، اتفاق میافتد [4].
وقایع ناخواسته دارویی همواره بهعنوان یک مسئله بهداشت عمومی، ابعاد مختلفی داشته و میتواند اثرات جبرانناپذیر و هزینههای فراوانی را برای افراد جامعه به همراه داشته باشد [5].پس از وقوع فاجعه تالیدوماید در دهه 1960 میلادی ضرورت توجه و شناسایی هرچه سریعتر عوارض جانبی داروهای واردشده به بازار احساس شد. بر همین اساس سازمان بهداشت جهانی در سال 1968 فارماکوویژیلانسی را بهمنظور نظارت بر بیخطری داروها پیریزی کرد. بنا به تعریف سازمان بهداشت جهانی به دانش و فعالیتهای مرتبط با ردیابی، ارزیابی، گزارشدهی و پیشگیری از عوارض دارویی یا سایر مشکلات مرتبط با دارو فارماکوویژیلانس گفته میشود. هدف عمده سیستمهای فارماکوویژیلانس شناسایی آن دسته از رویدادهای ناگوار مرتبط با مصرف داروهایی است که ناشناخته هستند [6].
در کشورهای مختلف روشهای متفاوتی بهمنظور شناسایی عوارض جانبی دارویی بهصورت داوطلبانه در مراکز گزارشدهی عوارض ناخواسته دارویی وجود دارد [7]. نخستین ایدهها درجهت رایانهای کردن ثبت و بررسی عوارض دارویی در اواسط دهه 1970 میلادی شکل گرفته است [8]. توسعه و راهاندازی این تکنیکهای رایانهای که بهطور عمده برمبنای تسهیل جستوجو و دستیابی به ارتباطات جدید عوارض دارویی است، همچنان رو به افزایش است [9]. همگام با فعالیتهای صورتگرفته در بسیاری از کشورهای جهان درزمینه بررسی عوارض دارویی، در کشور ما نیز مرکز ملی ثبت و بررسی عوارض ناخواسته داروها، عهدهدار سازماندهی فعالیتهای فارماکوویژیلانس و جمعآوری و بررسی گزارشات عوارض دارویی درسطح کشور است [6].
گزارشدهی عوارض ناخواسته دارویی در انگلستان از طریق «کارت زرد» است. این طرح گزارشدهی داوطلبانه در سال 1964 راهاندازی شد و اکنون وزارت نظارت بر داروها و محصولات بهداشتی ادارهاش میکند. سیستم گزارش «کارت زرد» بهعنوان اولین سیستم گزارشدهی در جهان شناخته شده است [10].
مدافکت یکی از استراتژیهای دسترسی به درمان در حال پیشرفت در کاناداست. استراتژی 5 ساله برای بهبود ایمنی، اثربخشی و دسترسی به محصولات درمانی که در اختیار کاناداییهاست با فراهم کردن دسترسی متمرکز به اطلاعات مناسب و قابلاطمینان، به گزارشدهی عوارض جانبی به وزارت بهداشت کانادا و شناسایی خطرات احتمالی با استفاده از این اطلاعات میپردازد [11]. در استرالیا گزارشهای داوطلبانه با استفاده از «کارت آبی» صورت میگیرد که متخصصان بهداشت، شرکتهای داروسازی و مصرف کنندگان ارسالشان میکنند. کمیته مشاوره واکنشهای دارویی که در سال 1970 تأسیس شد، گزارشهای ارسالی را ارزیابی میکند. سیستم «کارت آبی» استرالیا از نظر گزارشهای سرانه یکی از بهترینهای جهان است و نرخ گزارشهای آن بهمرور زمان افزایش یافته است [7].
در ایالات متحده آمریکا گزارشدهی به صورت برخط (به صورت الکترونیکی از سال 1997) یا از طریق تلفن، با ارسال فرم مشخص از طریق پست یا فکس انجام میشود. گزارشات عوارض ناخواسته دارویی در پایگاه داده سیستم گزارشدهی وارد میشوند و دفتر سازمان غذا و دارو آمریکا با ارزیابی خطر پس از بازاریابی، واکنشهای جدی را شناسایی میکند [12].
بهکارگیری عناصر استاندارد همراه با تعاریف یکسان بهعنوان مجموعه حداقل داده، به افزایش مقایسه و تطابق دادهها منجر میشود. در پزشکی جدید، دادههای زیادی تولید میشود، اما همواره بین گردآوری داده تا درک و تفسیر آن فاصلهای وجود دارد و از سوی دیگر دادههای دردسترس، حجیم و گیجکننده هستند. برای همین، مجموعه حداقل دادهها جمعآوری میشود که روش استانداردی برای جمعآوری عناصر دادهای کلیدی است تا فهم آسان و امکان مقایسه آنها فراهم شود و ملاحظات دولتی و نیازهای درونی هر مؤسسه و درنهایت جامعه پزشکی را برآورده کند [13]. در تمام کشورها فرم گزارشدهی داوطلبانه واکنش عوارض ناخواسته دارویی، مهمترین و اصلیترین ابزار سیستم مراقبت دارویی است. این فرم ابزار جمعآوری اطلاعات مرتبط به واکنشهای نامطلوب دارویی است که به شناخت رابطه علی بین داروی مشکوک و واکنش کمک میکند. ثبت اطلاعات ناکافی درباره واکنشهای نامطلوب دارویی موجب ناکارآمدی گزارشها برای مراجع نظارتی میشود، زیرا از اطلاعات هیچ نتیجه را نمیتوان استخراج کرد. اکثر کشورها فرم گزارشدهی داوطلبانه برای ثبت و جمعآوری دادههای مربوط واکنشهای نامطلوب دارویی خود ایجاد کردهاند. همچنین خبرنامه دارویی سازمان جهانی بهداشت نیاز به طراحی فرم عمومی برای گزارش داوطلبانه واکنشهای نامطلوب دارویی را مطرح کرده است [14].
فرایند گزارشدهی عوارض ناخواسته دارویی در ایران از سال 1377 بهصورت رسمی آغاز شده است و از طریق تکمیل و ارسال کارت زرد به مراکز گزارشدهی عوارض ناخواسته دارویی در معاونت غذا و دارو عوارض گزارش میشود. با طراحی وبسایت ملی ثبت گزارش عوارض ناخواسته دارویی از سال 1393 این فرایند تسهیل شده است. گزارشدهی عوارض جانبی داروها به طور مستمر موجب شناسایی، جمعآوری و ارزیابی کارآمد عوارض دارویی میشود. با تعیین عوارض، حمایت از تصمیمگیری در مورد داروها در سطوح مختلف سیستم مراقبتهای بهداشتی نیز تسهیل میشود [15, 16].
این مطالعه با هدف بررسی تفاوتهای سیستم گزارش عوارض ناخواسته دارویی ایران با سایر کشورهای در این حوزه انجام شد. در طی بررسی عناصر اطلاعاتی، شناسایی و نیاز به وجود عناصر دادهای مشترک جهت مقایسه با دادههای بینالمللی مشخص شد. درنهایت این مطالعه با هدف تعیین مجموعه حداقل دادههای موردنیاز گزارشدهی عوارض ناخواسته دارویی انجام شد.
مواد و روشها
این مطالعه از نوع کاربردی بود که به روش توصیفیتطبیقی و با استفاده از تکنیک دلفی در سال 1399 در سه مرحله انجام شد.
در مرحله اول، بررسی متون و انتخاب کشورها شامل، آمریکا، کانادا، انگلستان و استرالیا بهجهت سرآمد بودن درزمینه ثبت عوارض ناخواسته دارویی و داشتن برنامه جامع و الگو صورت گرفت. همچنین کشور هندوستان بهدلیل قرابت جغرافیایی در قاره آسیا با ایران برای بررسی برنامههای نظارت بر عوارض ناخواسته دارویی انتخاب شد. دستورالعملها، فرمها و وبسایتهای طراحیشده در این کشورها جهت ثبت و گزارش عوارض ناخواسته دارویی بررسی گردید. پایگاههای اطلاعاتی معتبر نظیر وبآوساینس، اسکوپوس و پابمد براساس ترکیبات مختلف کلیدواژههای adverse drug reaction reporting systems, drug side effect, drug adverse reactions, adverse drug events, AND “Health Information Systems, Health Information Systems, Health Informatics Systems, medical Informatics Systems , Set Data Minimum از سال 2010 تا 2020 جستوجو شدند.
در مرحله دوم، بر اساس جداول تطبیقی، لیستی از مجموعه حداقل داده با توجه به وجوه اشتراک و افتراق در عناصر اطلاعاتی کشورهای منتخب تنظیم شد. بدینترتیب که اگر عناصر اطلاعاتی در بیش از دو کشور یا بیشتر موجود بود، در مجموعه حداقل داده پیشنهادی قرار گرفت. در مرحله آخر اعتبارسنجی مجموعه حداقل داده پیشنهادی با استفاده از روش دلفی با نظرخواهی از 15 صاحبنظر انجام شد. ملاک انتخاب این افراد تحصیلات مرتبط دکتری داروسازی، مدیریت اطلاعات سلامت و داشتن سابقه فعالیت درزمینه ثبت عوارض ناخواسته دارویی و داشتن تخصص در حوزه مدیریت اطلاعات سلامت بود. بدینترتیب لیست مجموعه حداقل دادههای اولیه پیشنهادی با مقیاس لیکرت 5 گزینهای طراحی و برای هر عنصر داده با توجه به اهمیت ارزش 1 (خیلی کم) تا 5 (خیلی زیاد) در نظر گرفته شد. روایی مجموعه حداقل داده اولیه پیشنهادی، براساس نظرات سه نفر از خبرگان حوزه مدیریت اطلاعات سلامت و دو نفر داروساز که با با سیستمهای گزارشدهی عواض دارویی آشنا بودند، سنجیده شد. سپس مجموعه حداقل داده پیشنهادی به صورت الکترونیک و حضوری در اختیار صاحبنظران قرار داده شد. پس از امتیازدهی صاحبنظران، تمامی عناصر داده با کسب درجه اهمیت بیشتر از 3 در مجموعه حداقل دادههای ثبت عوارض ناخواسته دارویی قرار گرفتند. عناصری که ارزش اهمیت بهدستآمده کمتر از 2 را کسب کردند، از مجموعه حداقل داده پیشنهادی حذف شدند. صاحبنظران مشتمل بر 12 داروساز با تحصیلات دکترای عمومی داروسازی و مسئولین گزارش عوارض ناخواسته دارویی در بیمارستان و 3 متخصص مدیریت اطلاعات سلامت بودند. این افراد بهصورت داوطلبانه به همکاری دعوت شدند. جهت گردآوری دادهها از فرم استخراج داده استفاده شد که شامل اطلاعات مربوط به دارو، بیمار، عارضه، بیمارستان، گزارشگر، نحوه تهیه دارو، سابقه پزشکی و اقدامات و سابقه پزشکی و تست آزمایشگاهی بود . این اطلاعات وارد نرمافزار اکسل نسخه 2019 شد.
یافتهها
درمجموع 109عنصر داده شناسایی شد. بر اساس وجوه اشتراک در کشورهای منتخب، 45 عنصر داده به نظرسنجی گذاشته شد که درباره 33 عنصر داده در مرحله اول دلفی توافق جمعیشد. 6 عنصر (شماره پرونده پزشکی بیمار، تاریخ تولد بیمار، فکس یا ایمیل بیمارستان، آدرس گزارشگر، شهر/کشور گزارشگر و دسترسی به دارو) پس از مصرف حذف شدند. 6 عنصر (آدرس بیمارستان، ثبت علت احتمالی ایجادعارضه، فراوانی ، علت مصرف، تلفن/ایمیل گزارشگر و اقدام انجامشده) درصورت بروز عارضه بین 2 تا 3 نمره کسب کردند و وارد مرحله دوم دلفی شدند. پس از انجام دور دوم دلفی، 39 عنصر داده درمجموع حداقل نهایی مورد اجماع صاحبنظران قرار گرفت (جدول شماره 1).


طبق نتایج مطالعه حاضر بعد از بررسی کشورهای منتخب و انجام دلفی، 39 عنصر اطلاعاتی در 7 محور مشخص شد: اطلاعات بیمار (8 عنصر)، بیمارستان (2 عنصر)، عارضه (7 عنصر)، دارو (11 عنصر)، نحوه تهیه دارو (3 عنصر)، گزارشگر (4 عنصر اطلاعاتی) و سایر موارد (4 عنصر اطلاعاتی) (جدول شماره 2).
.jpg)
سیستم گزارش «کارت زرد» انگلستان بهعنوان اولین سیستم گزارشدهی در جهان مواردداروی مشکوک، واکنشهای مشکوک، جزئیات اطلاعات بیمار، اطلاعات گزارشدهنده، اطلاعات تکمیلی و واکنشهای جدی را گزارش میدهد [10].
در کانادا یک وبسایت برای همکاری انجمنهای متخصصین مراقبت سلامت و گروههای مصرفکننده / بیمار طراحی شده است و الزامات اطلاعاتی برای عوارض جانبی شامل نام بیمارستان و اطلاعات تماس نماینده آن بیمارستان، نام تجاری دارو یا نام عمومی آن، شماره شناسایی اختصاص دادهشده برای دارو، سن و جنس بیمار، توصیف واکنش جدی جانبی دارویی، تاریخی که برای اولین بار واکنش جدی دارویی ثبت شده است، تاریخی که بیمار برای اولین بار از دارو استفاده کرده، تاریخی که در آن اولین واکنش جانبی جدی دارویی رخ داده است و درصورت وجود، تاریخی که سلامتی بیمار قبل از واکنش به حالت قبل برگردانده شده است، هر وضعیت پزشکی بیمار که مستقیماً به واکنش جدی و جانبی دارو مربوط میشود، هرگونه محصول درمانی که همزمان بیمار استفاده میکند و تأثیر واکنش جدی جانبی دارویی بر سلامت بیمار را دربر میگیرد [17]
در ایران، وزارت بهداشت سیستم ملی گزارشدهی عوارض ناخواسته دارویی را در سال 1370 تأسیس کرد. درسال 1377 سازمان بهداشت جهانی این سیستم را پذیرفت. کلیه دانشگاههای علومپزشکی و مراکز دولتی و خصوصی، مسئولیت ارسال گزارش را برعهده دارند. حداقل اطلاعات لازم جهت گزارش عارضه ناخواسته دارویی: مشخصات بیمار، مشخصات گزارشگر عارضه رخداده مشکوک به مصرف دارو و نام دارو/داروهای مشکوک به ایجاد عارضه [15 ،9]
بحث
گزارشدهی عوارض ناخواسته دارویی بهعنوان بخش مهمی از نظارت و ایمنی دارو در سطح بینالمللی در نظر گرفته میشود [18]. پراکندگی اطلاعات، حجم زیاد دادهها وعدم دسترسی بهموقع به آنها برای ارائهدهندگان مراقبتهای بهداشتی، مستندسازی ضعیف اطلاعات و وجود اطلاعات تکراری ازجمله مشکلات سیستمهای اطلاعاتی موجود است. بهکارگیری عناصر استاندارد همراه با تعاریف یکسان بهعنوان مجموعه حداقل داده، به افزایش میزان درک و تفسیر دادهها منجر میشود [19]. سازمان بهداشت جهانی اطلاعات مربوط به عوارض جانبی را از تمام کشورهای عضو برنامه بینالمللی نظارت بر دارو دریافت میکند. بنابراین دادههای دریافتشده باید یکنواخت و کامل باشد تا بتوان نتیجهگیریهای معنیدار به دست آورد [14].
تمام کشورها اعم از پیشرفته و در حال توسعه از اهمیت وجود برنامه نظارت برعوارض ناخواسته دارویی آگاهی داشتند و چنین برنامهای را اجرا میکردند. در این میان انگلستان از سال 1964 پیشتاز بوده است. هندوستان و عربستان از سال 1997 و 2003 به برنامه جهانی پیوستند. در ایران در ژوئن سال 1998 سیستم ملی گزارشدهی راهاندازی شد [12]. نحوه ارسال گزارشات در تمام کشورها بهصورت ساده و کاغذی، وبسایت و تلفن/فکس است. در استرالیا ارسال گزارشات بهصورت کاغذی وجود ندارد. از اپلیکیشن فقط درکانادا، انگلستان، آمریکا، هندوستان و ایران استفاده میشود. در مطالعه والینسیوت-یانکائوسکین روی 12 کشور اروپایی نیز روشهای مورداستفاده برای گزارشدهی عوارض ناخواسته دارویی، پست مستقیم، ایمیل، تماس تلفنی، فکس و روشهای آنلاین مبتنی بر اینترنت بود. در استونی و اتریش تماس تلفنی علاوه بر فرم کتبی استفاده میشود. در مطالعه در فنلاند هم فرم گزارش آنلاین وجود نداشت [20]. در مطالعه نوکیک و همکاران در پنج کشور آسیایی فیلیپین، نپال، کامبوج، تایلند و بنگلادش، در همه کشورها بهجز بنگلادش از فناوریهای ارتباطی برای گزارش عوارض دارو ازجمله تلفن، فکس، اینترنت، ایمیل، رایانه و نرمافزار برای گزارش استفاده میشود [21].
در مطالعه مارگراف مشخص شد از 44 کشور موردبررسی درمجموع 31 کشور گزارش آنلاین و کاغذی دارند، 11 کشور فقط از گزارش کاغذی استفاده میکردند و در هند بیماران از طریق تلفن گزارش میدهند، در نیجریه پیامهای متنی ارسال میشود. 68 درصد کشورها سابقه بیماری و 93 درصد کشورها درمان همزمان و 95 درصد کشورها ارزیابی علت برای تجزیهوتحلیل بهتر در فرمها در نظر گرفته بودند [22].
در مطالعه حاضر اطلاعات بیماران شامل سن، جنسیت، قد، وزن، حاملگی / شیردهی، بیماری زمینهای، آلرژی، قومیت و نژاد بود و در مطالعه بایلی برای توصیف وضعیت بیمار عناصر داده شامل اطلاعات جمعیتشناختی و سابقه پزشکی بود و بر گزارش سن و جنس تأکید شده بود [23]. طبق مطالعه باندکار ثبت آلرژی و وضعیت بارداری از پارامترهای مهم برای ارزیابی علت وقوع عوارض ناخواسته دارویی در بیماران زن است و در تمام کشورها بررسی میشود [14].
در مطالعه بایلی و همکاران اکثر سیستمهای موردبررسی نشان داد که طراحی توسط خود کشورها بوده و در وبسایتهای سازمانهای داروسازی استفاده میشدند. در این وبسایتها درجه بالایی از تنوع و عدم استانداردسازی بین سیستمها مشهود بود. اصطلاحات، عبارات و سؤالات متعددی برای متغیرهای مشابه استفاده میشد و تعاریف استانداردی وجود نداشت. برای مثال، اصطلاحات حادثه جانبی، واکنش ناخواسته، حادثه و مشکل مربوط به دارو همه بهجای یکدیگر و بدون تعریف صریح استفاده میشوند. فقدان استاندارد بین سیستمها به احتمال زیاد قابلیت مقایسه دادههای تولیدشده با استفاده از سیستمهای مختلف را محدود میکند و ممکن است تلاشها را برای تجمیع و تجزیهوتحلیل دادهها تضعیف کند [23]. تفاوتها و تنوع دادهها در مجموعه داده کشورهای منتخب، نیازسنجی از ذینفعان و کسب نظر متخصصین برای تعیین مجموعه حداقل داده اهمیت دارد.
نتیجهگیری
بهکارگیری عناصر استاندارد همراه با تعاریف یکسان به عنوان مجموعه حداقل داده، به افزایش میزان درک و تفسیر دادهها منجر میشود. بنابراین دادههای تولیدشده در حوزه عوارض دارو باید یکنواخت و کامل باشند تا بتوان نتیجهگیریهای معنیدار به دست آورد. در تمام کشورها فرم گزارشدهی داوطلبانه واکنش عوارض ناخواسته دارویی، مهمترین و اصلیترین ابزار سیستم مراقبت دارویی است. تفاوتها و تنوع دادهها در مجموعه داده کشورها، نیازسنجی از ذینفعان و کسب نظر متخصصین برای تعیین مجموعه حداقل داده اهمیت دارد. در ایران در ژوئن سال 1998 سیستم ملی گزارشدهی راهاندازی شد. انتظار میرود سامانه ملی با استفاده از مجموعه حداقل دادههای این مطالعه براساس نیازهای کاربران و استانداردها طراحی و مجدداً بازبینی شود.
یکی از محدودیتهای این مجموعه نبود دسترسی آسان به فرمهای گزارشدهی بود. محدودیت دیگر دستهبندی زیرمجموعهها بر اساس فراوانی آنها و پراکنده بودن زیاد در کشورهای موردمطالعه بود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله برگرفته از پایاننامه کارشناسی ارشد مصوب جلسه شورای پژوهشی دانشگاه علومپزشکی مشهد با کد اخلاق IR.MUMS.REC.1398.056 است.
حامی مالی
این مقاله حاصل پایاننامه کارشناسی ارشد هانیه بامری با عنوان «ارزیابی کاربردپذیری و بررسی قابلیتهای عملکردی سامانه ملی ثبت عوارض ناخواسته دارویی» است که دانشگاه علومپزشکی مشهد و با کد طرح 971701 آن را تصویب کرده است. همچنین این مطالعه با حمایت مالی معاونت پژوهشی دانشگاه علومپزشکی مشهد انجام شده است.
مشارکت نویسندگان
بررسی مقالات مطالعه، مقدمه، روش، بحث و نتیجهگیری: مرضیه معراجی و هانیه بامری، انتخاب مطالعه: سمیه فضائلی و زهرا ابن حسینی؛ ویرایش: سمیه فضائلی.
تعارض منافع
بنابر اظهار نویسندگان در این مقاله تعارض منافع وجود ندارد.
تشکر و قدردانی
نویسندگان از دانشگاه علومپزشکی مشهد برای حمایت از این پروژه تشکر می کنند.
References
1.Moayeri A, Aminshokravi F, Tavafian S, Moayeri A. [Assessing related factors on the illicit use of medications in Abbas Abad City(mazandaran): A cross sectional study (Persian)]. J Ilam Univ. 2014; 22(5):11-9. [Link]
2.U.S. Fodd and Drug Administration. FDA adverse event reporting system (FAERS) public dashboard. U.S. Maryland: Fodd and Drug Administration; 2021. [Link]
3.Alomar M, Tawfiq AM, Hassan N, Palaian S. Post marketing surveillance of suspected adverse drug reactions through spontaneous reporting: Current status, challenges and the future. Ther Adv Drug Saf. 2020; 11:2042098620938595. [PMID]
4.World Health Organization. Safety of medicines: A guide to detecting and reporting adverse drug reactions: Why health professionals need to take action. Geneva: World Health Organization; 2002. [Link]
5.Toki T, Ono S. Spontaneous reporting on adverse events by consumers in the United States: An analysis of the food and drug administration adverse event reporting system database. Drugs Real World Outcomes. 2018; 5(2):117-28. [DOI:10.1007/s40801-018-0134-0] [PMID] [PMCID]
6.Pal SN, Duncombe C, Falzon D, Olsson S. WHO strategy for collecting safety data in public health programmes: Complementing spontaneous reporting systems. Drug Saf. 2013; 36(2):75-81. [DOI:10.1007/s40264-012-0014-6] [PMID] [PMCID]
7.Linger M, Martin J. Pharmacovigilance and expedited drug approvals. Aust Prescr. 2018; 41(2):50-3. [DOI:10.18773/austprescr.2018.010] [PMID] [PMCID]
8.Shalviri G, Mohammad K, Majdzadeh S, Gholami K. [Comparing epidemiological methods in detecting drug safety signal in Iran (Persian)]. Iran J Epidemiol . 2005; 1 (1 and 2) :17-26. [Link]
9.Baniasadi S, Fahimi F, Shalviri G. Developing an adverse drug reaction reporting system at a teaching hospital. Basic Clin Pharmacol Toxicol. 2008; 102(4):408-11. [DOI:10.1111/j.1742-7843.2008.00217.x] [PMID]
10.Medicines and Healthcare products Regulatory Agency. About Yellow Card Medicines and Healthcare products Regulatory Agency [Internet]. 2020. https://yellowcard.mhra.gov.uk/
11.Government of Canada. About medeffect Canada. Toronto: Government of Canada; 2007. [Link]
12.Rabbur RS, Emmerton L. An introduction to adverse drug reaction reporting systems in different countries. Int J Pharm Pract. 2005;13(1):91-100. [DOI:10.1211/0022357055821]
13.Meraji M, Mahmoodian S, Ramezanghorbani N, Eslami F, Sarabi E. [Management of congenital anomalies in Iran: Developing a national minimum data set (Persian)]. J Health Adm. 2018; 21(73):49-60. [Link]
14.Bandekar MS, Anwikar SR, Kshirsagar NA. Quality check of spontaneous adverse drug reaction reporting forms of different countries. Pharmacoepidemiol Drug Saf. 2010; 19(11):1181-5. [DOI:10.1002/pds.2004] [PMID]
15.Food and Drug Administration.[ History of adverse drug reaction (Persian)]. Tehran: Food and Drug Administration. [Link]
16.Khalili M, Sharifi H, Mesgarpour B, Kheirandish M, Olsson S, Javidnikou N, et al. Evaluation of pharmacovigilance system in Iran. Int J Health Policy Manage. 2022; 11(7):990-1000. [DOI:10.34172/IJHPM.2020.243]
17.Government of Canada. Mandatory reporting of serious adverse drug reactions and medical device incidents by hospitals - guidance document. Toronto: Government of Canada; 2020. [Link]
18.Singh A, Bhatt P. Comparative evaluation of adverse drug reaction reporting forms for introduction of a spontaneous generic ADR form. J Pharmacol Pharmacother. 2012; 3(3):228-32. [DOI:10.4103/0976-500X.99417] [PMID] [PMCID]
19.Ampadu HH, Hoekman J, de Bruin ML, Pal SN, Olsson S, Sartori D, et al. Adverse drug reaction reporting in Africa and a comparison of individual case safety report characteristics between Africa and the rest of the world: Analyses of spontaneous reports in VigiBase®. Drug Saf. 2016; 39(4):335-45. [DOI:10.1007/s40264-015-0387-4] [PMID] [PMCID]
20.Valinciute-Jankauskiene A, Kubiliene L. Adverse drug reaction reporting by patients in 12 European countries. Int J Environ Res Public Health. 2021; 18(4):1507. [DOI:10.3390/ijerph18041507] [PMID] [PMCID]
21.Nwokike J, Ludeman E, Thumm M. Comparative analysis of pharmacovigilance systems in five Asian countries. Washington: United States Agency for International Development; 2013. [Link]
22.Margraff F, Bertram D. Adverse drug reaction reporting by patients: An overview of fifty countries. Drug Saf. 2014; 37(6):409-19. [DOI:10.1007/s40264-014-0162-y] [PMID]
23.Bailey C, Peddie D, Wickham ME, Badke K, Small SS, Doyle-Waters MM, et al. Adverse drug event reporting systems: A systematic review. Br J Clin Pharmacol. 2016; 82(1):17-29. [DOI:10.1111/bcp.12944] [PMID] [PMCID]
2.U.S. Fodd and Drug Administration. FDA adverse event reporting system (FAERS) public dashboard. U.S. Maryland: Fodd and Drug Administration; 2021. [Link]
3.Alomar M, Tawfiq AM, Hassan N, Palaian S. Post marketing surveillance of suspected adverse drug reactions through spontaneous reporting: Current status, challenges and the future. Ther Adv Drug Saf. 2020; 11:2042098620938595. [PMID]
4.World Health Organization. Safety of medicines: A guide to detecting and reporting adverse drug reactions: Why health professionals need to take action. Geneva: World Health Organization; 2002. [Link]
5.Toki T, Ono S. Spontaneous reporting on adverse events by consumers in the United States: An analysis of the food and drug administration adverse event reporting system database. Drugs Real World Outcomes. 2018; 5(2):117-28. [DOI:10.1007/s40801-018-0134-0] [PMID] [PMCID]
6.Pal SN, Duncombe C, Falzon D, Olsson S. WHO strategy for collecting safety data in public health programmes: Complementing spontaneous reporting systems. Drug Saf. 2013; 36(2):75-81. [DOI:10.1007/s40264-012-0014-6] [PMID] [PMCID]
7.Linger M, Martin J. Pharmacovigilance and expedited drug approvals. Aust Prescr. 2018; 41(2):50-3. [DOI:10.18773/austprescr.2018.010] [PMID] [PMCID]
8.Shalviri G, Mohammad K, Majdzadeh S, Gholami K. [Comparing epidemiological methods in detecting drug safety signal in Iran (Persian)]. Iran J Epidemiol . 2005; 1 (1 and 2) :17-26. [Link]
9.Baniasadi S, Fahimi F, Shalviri G. Developing an adverse drug reaction reporting system at a teaching hospital. Basic Clin Pharmacol Toxicol. 2008; 102(4):408-11. [DOI:10.1111/j.1742-7843.2008.00217.x] [PMID]
10.Medicines and Healthcare products Regulatory Agency. About Yellow Card Medicines and Healthcare products Regulatory Agency [Internet]. 2020. https://yellowcard.mhra.gov.uk/
11.Government of Canada. About medeffect Canada. Toronto: Government of Canada; 2007. [Link]
12.Rabbur RS, Emmerton L. An introduction to adverse drug reaction reporting systems in different countries. Int J Pharm Pract. 2005;13(1):91-100. [DOI:10.1211/0022357055821]
13.Meraji M, Mahmoodian S, Ramezanghorbani N, Eslami F, Sarabi E. [Management of congenital anomalies in Iran: Developing a national minimum data set (Persian)]. J Health Adm. 2018; 21(73):49-60. [Link]
14.Bandekar MS, Anwikar SR, Kshirsagar NA. Quality check of spontaneous adverse drug reaction reporting forms of different countries. Pharmacoepidemiol Drug Saf. 2010; 19(11):1181-5. [DOI:10.1002/pds.2004] [PMID]
15.Food and Drug Administration.[ History of adverse drug reaction (Persian)]. Tehran: Food and Drug Administration. [Link]
16.Khalili M, Sharifi H, Mesgarpour B, Kheirandish M, Olsson S, Javidnikou N, et al. Evaluation of pharmacovigilance system in Iran. Int J Health Policy Manage. 2022; 11(7):990-1000. [DOI:10.34172/IJHPM.2020.243]
17.Government of Canada. Mandatory reporting of serious adverse drug reactions and medical device incidents by hospitals - guidance document. Toronto: Government of Canada; 2020. [Link]
18.Singh A, Bhatt P. Comparative evaluation of adverse drug reaction reporting forms for introduction of a spontaneous generic ADR form. J Pharmacol Pharmacother. 2012; 3(3):228-32. [DOI:10.4103/0976-500X.99417] [PMID] [PMCID]
19.Ampadu HH, Hoekman J, de Bruin ML, Pal SN, Olsson S, Sartori D, et al. Adverse drug reaction reporting in Africa and a comparison of individual case safety report characteristics between Africa and the rest of the world: Analyses of spontaneous reports in VigiBase®. Drug Saf. 2016; 39(4):335-45. [DOI:10.1007/s40264-015-0387-4] [PMID] [PMCID]
20.Valinciute-Jankauskiene A, Kubiliene L. Adverse drug reaction reporting by patients in 12 European countries. Int J Environ Res Public Health. 2021; 18(4):1507. [DOI:10.3390/ijerph18041507] [PMID] [PMCID]
21.Nwokike J, Ludeman E, Thumm M. Comparative analysis of pharmacovigilance systems in five Asian countries. Washington: United States Agency for International Development; 2013. [Link]
22.Margraff F, Bertram D. Adverse drug reaction reporting by patients: An overview of fifty countries. Drug Saf. 2014; 37(6):409-19. [DOI:10.1007/s40264-014-0162-y] [PMID]
23.Bailey C, Peddie D, Wickham ME, Badke K, Small SS, Doyle-Waters MM, et al. Adverse drug event reporting systems: A systematic review. Br J Clin Pharmacol. 2016; 82(1):17-29. [DOI:10.1111/bcp.12944] [PMID] [PMCID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |








